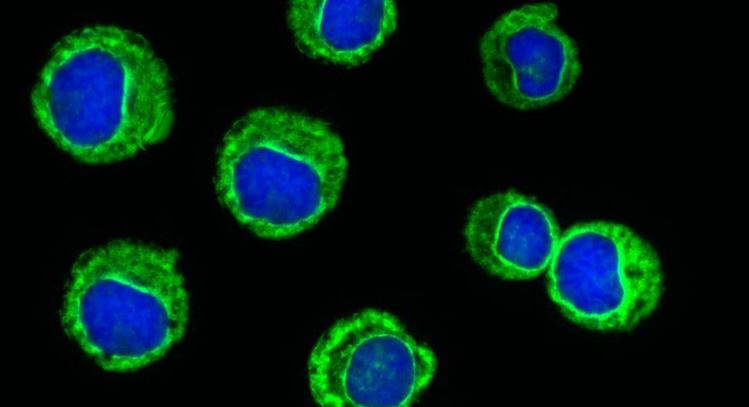
I ricercatori dell’Università della California, San Francisco, hanno sfruttato con successo un farmaco approvato dalla FDA (Food and Drug Administration degli Stati Uniti, l’agenzia all’interno del Dipartimento della salute e dei servizi umani degli Stati Uniti, protegge la salute pubblica assicurando l’efficacia e la sicurezza dei farmaci umani e veterinari, dei vaccini e di altri prodotti biologici per uso umano e dei dispositivi medici), per fermare la crescita dei tumori guidati dalle mutazioni del gene RAS, che sono notoriamente difficili da trattare e rappresentano circa un decesso su quattro per cancro.
I ricercatori approfittando di quello che hanno scoperto essere l’appetito delle cellule tumorali per una forma reattiva di ferro, hanno ottimizzato un farmaco antitumorale per agire solo in queste cellule ricche di ferro, lasciando che altre cellule funzionino normalmente. Il risultato, descritto nel numero del 9 marzo 2022 della rivista Journal of Experimental Medicine, potrebbe aprire le porte a una chemioterapia più tollerabile per molti tumori in cui i trattamenti attuali possono essere difficili quanto la malattia.
Eric Collisson autore senior dello studio, membro dell’Helen Diller Family Comprehensive Cancer Center dell’Università della California, San Francisco, ha detto:
«Le mutazioni RAS, di per sé, causano più sofferenza di tutti gli altri tumori messi insieme, prendono così tante vite in tutto il mondo, questo studio ci avvicina molto all’affrontare il bisogno insoddisfatto di un migliore trattamento di questi tumori».
Farmaco contro il cancro con un sensore di ferro
Eric Collisson e Honglin Jiang (entrambi oncologi dell’Università della California, San Francisco), insieme a Adam Renslo, chimico farmaceutico anche lui dell’Università della California, San Francisco, e co-autore senior, si sono concentrati sui tumori del pancreas e gastrointestinale con mutazione RAS. Il gene RAS svolge un ruolo nel reprimere i percorsi nella cellula che la guidano a crescere e dividersi. Le mutazioni nel gene di solito significano che queste forze di crescita non vengono controllate, portando al cancro.
I trattamenti attuali, con un farmaco chiamato Cobimetinib, fanno un buon lavoro nel bloccare questa attività di crescita eccessiva messa in moto dalla mutazione, ma lo fanno anche in molti altri tessuti non cancerosi, causando gravi effetti collaterali, intollerabili per molti pazienti.
Adam Renslo ha affermato:
«Cobimetinib è un classico esempio di un farmaco antitumorale che funziona bene sul suo obiettivo, ma non ha raggiunto il suo potenziale clinico perché lo stesso obiettivo è importante nella pelle e in altri tessuti normali».
I ricercatori studiando un tipo di mutazione nel gene RAS chiamato mutazioni KRAS, hanno riscontrato livelli più elevati di ferro ferroso, che sono correlati a tempi di sopravvivenza più brevi.
Adam Renslo insieme a Ryan Muir per sfruttare questa caratteristica unica delle cellule tumorali, hanno sintetizzato una nuova versione di Cobimetinib contenente un piccolo sensore molecolare di ferro ferroso. Il sensore disattiva efficacemente Cobimetinib fino a quando non incontra ferro ferroso nelle cellule tumorali.
I ricercatori dopo aver confermato che il nuovo farmaco, soprannominato TRX-cobimetinib, previene gli effetti avversi sui tessuti normali come la pelle che limitano il dosaggio nei pazienti umani, hanno testato il composto in modelli murini di diversi tumori collegati alla forma KRAS, hanno scoperto che nel restringimento dei tumori era efficace quanto Cobimetinib.
Abilitazione di nuove combinazioni di farmaci
La ridotta tossicità ha permesso ai ricercatori di combinare il farmaco TRX-cobimetinib con altri farmaci antitumorali sinergici, e fornire trattamenti combinati che si sono rivelati migliori nell’inibire la crescita del tumore, e sono stati meglio tollerati rispetto a combinazioni comparabili con Cobimetinib.
Adam Renslo ha detto:
«Rimuovendo la tossicità dall’equazione, non solo ottieni un nuovo farmaco, ma puoi avere 10 nuove combinazioni che ora puoi testare in clinica».
Adam Renslo è già al lavoro per studiare se un simile metodo può essere applicato agli antibiotici, alcuni dei quali hanno effetti collaterali negativi, per indirizzare il trattamento e ridurre la tossicità.
Eric Collisson, che lavora ogni giorno con i pazienti alle prese con questi tumori, ha affermato:
«La collaborazione con Adam Renslo mi ha dato la speranza, in un futuro non troppo lontano, di poter offrire a quei pazienti opzioni migliori. L’esperienza mi ha aperto gli occhi su elementi che mi erano mancati, essendo concentrato sul mio quotidiano mondo oncologico. Adoro prendermi cura dei pazienti, una parte fondamentale di questo è, in definitiva, portare una molecola nel punto in cui è necessaria e tenerla fuori dai luoghi in cui non è necessaria. È gratificante poter fornire una terapia cinque volte più potente di quella che abbiamo attualmente e non gestire il paziente in modo irregolare».